Le gène Notch, qui code un récepteur transmembranaire, a été identifié initialement chez la drosophile et joue un rôle majeur dans la biologie des eucaryotes [ 1]. Plusieurs études portant sur des analyses de gain ou de perte de fonction ont démontré le rôle de la signalisation Notch aussi bien au cours du développement que chez l’adulte. Cette voie de signalisation est impliquée dans l’inhibition de la différenciation cellulaire de plusieurs tissus mais aussi dans l’amplification des cellules souches neuronales et hématopoïétiques. Dans l’intestin, les cellules épithéliales présentent un taux de renouvellement très rapide (3 à 5 jours), assuré par la prolifération des cellules précurseurs constamment produites dans la région profonde des cryptes. Cela constitue une propriété remarquable de ce tissu. Cependant, il persiste de nombreuses zones d’ombre sur les mécanismes qui contrôlent la différenciation de ces cellules en cellules épithéliales matures.
Deux approches réciproques, par gain de fonction [ 2] ou par perte de fonction [ 3], illustrent le rôle essentiel de la voie Notch dans le devenir des cellules précurseurs de l’épithélium intestinal et sont rapportées simultanément dans la revue Nature du 16 juin 2005 (Figure 1).
L’expression constitutive de la forme activée du récepteur Notch1 (N1ic) [2] est obtenue par croisement de souris qui présentent un allèle floxé de N1ic dans le locus rosa 26 [ 4] avec les souris qui expriment la Cre recombinase sous le contrôle des régions promotrices du gène de la villine [ 5]. L’inhibition de la voie Notch [3] est obtenue par croisement de souris invalidées pour un effecteur de Notch, RBP-J [ 6], avec deux types de souris qui expriment : (1) la Cre recombinase sous le contrôle du promoteur inductible P450 [ 7] permettant une expression hépatique et intestinale du transgène ; (2) la Cre recombinase fusionnée au domaine de liaison des œstrogènes sous le contrôle du promoteur villine, permettant de restreindre l’expression exclusivement à l’épithélium intestinal [5].
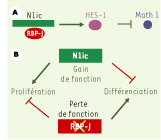
| Figure 1.
Représentation schématique de la signalisation Notch dans l’intestin de mammifère.
A. Après clivage membranaire, le domaine intracellulaire de Notch (N1ic) interagit avec un co-activateur (RBP-J), ce qui aboutit à la translocation nucléaire du complexe. Il en résulte la transcription de gènes tels que Hairy-enhancer of spli (Hes-1). Cette famille de protéines de liaison à l’ADN, à domaine bHLH conduit à une répression de l’expression de gènes tels que Math 1. B. Phénotype « en miroir » de l’activation de la voie Notch (gain de fonction) et de l’inactivation de la voie Notch (perte de fonction). |
L’article de S. Fre et al. [2] montre que l’expression constitutive de la forme activée du récepteur Notch1 (N1ic) dans l’épithélium intestinal de souris aboutit à une mortalité des animaux dans les jours qui suivent la naissance. Ce phénotype se manifeste par une absence presque complète des populations de cellules du lignage sécrétoire de l’épithélium intestinal. Au niveau transcriptionnel, la surexpression de Nic conduit à l’expression d’une des cibles connues de la voie Notch, la protéine Hes-1, sans affecter l’expression d’autres gènes cibles de la même famille tels que Hes-5 ou de Hey-1. Ce résultat démontre que Hes-1 est l’effecteur majeur de la voie Notch dans l’intestin. La surexpression de Hes-1 entraîne une répression de l’expression des protéines qui codent les gènes proneuronaux math1 et neurogenin-3, impliqués dans la spécification des cellules sécrétoires (Figure 1).
La prolifération cellulaire analysée par ces auteurs à l’aide du marqueur de prolifération Ki67, en combinaison avec l’incorporation de bromodésoxyuridine (BrdU), montre clairement que l’activation de Notch aboutit à une expansion du compartiment prolifératif. Ce compartiment s’étend au-delà de la région inter-villositaire chez la souris nouveau-né (Figure 2). L’analyse à l’échelle ultrastructurale du pôle apical des cellules des animaux N1ic le long de l’axe villositaire, comparée à celle d’un animal témoin, montre une densité faible de microvillosités. Cette structure ressemble aux bordures en brosse des cellules indifférenciées des cryptes intestinales.
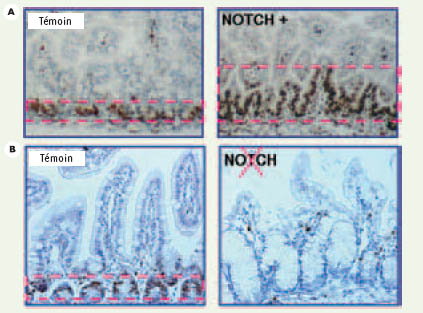
| Figure 2.
Analyse de la prolifération cellulaire dans deux modèles d’animaux transgéniques permettant soit l’activation de la voie Notch [2] ou l’inhibition de la voie Notch [3] comparée à celle des animaux témoins à la naissance (panneauA réalisé sur des nouveau-nés, témoins et Notch+) ou chez l’adulte (panneau B réalisé sur des adultes, témoins et Notch invalidé). Le marquage des cellules en division (Ki67) met en évidence l’expansion du compartiment prolifératif des animaux Notch+ et l’absence complète de prolifération des animaux dont la voie Notch est invalidée. |
En conclusion, les résultats présentés par S. Fre et al. mettent en valeur le rôle de la voie Notch dans le contrôle de la population des cellules progénitrices de l’épithélium intestinal et dans celui de la différenciation terminale de l’intestin (Figure 1). Cependant, l’identification et la caractérisation des cellules progénitrices induites par Notch restent à établir. Les conclusions apportées par ces auteurs sont en accord avec les travaux de J.H. Van Es et al. qui ont obtenu un phénotype « en miroir » en inhibant la voie de signalisation Notch par deux approches. En effet, soit par la délétion d’un effecteur de Notch CSL/RBP-J, soit par l’utilisation d’un inhibiteur des γ-sécrétases, enzyme responsable du clivage du domaine intracellulaire de Notch, ces auteurs montrent une conversion très rapide des cellules prolifératives des cryptes intestinales en cellules différenciées produisant du mucus (Figure 2). Par la suite, ils montrent l’activation de la voie Notch dans les processus hyperprolifératifs de type adénome développés par les souris Min qui présentent une mutation germinale dans le gène apc. Ce résultat les conduit à tester l’effet de l’inhibiteur des γ-sécrétases sur les souris Min et à montrer une réduction importante de la prolifération des adénomes et une conversion de ces cellules en cellules à mucus quand la voie Notch est réprimée par cette approche. Ce résultat démontre pour la première fois que la stratégie de conversion du processus prolifératif vers la voie de différenciation, déjà utilisée avec succès dans certaines pathologies du système hématopoïétique comme les leucémies promyéloïdes [ 8], pourrait être appliquée aux tumeurs solides. Il ouvre la voie vers une nouvelle approche thérapeutique des cancers colorectaux.